Buenos días mis estudiantes, espero tengan un lindo día lleno de aprendizajes.
FENÓMENOS ONDULATORIOS DEL SONIDO
Los fenómenos ondulatorios del sonido se refieren a las diversas maneras en que las ondas sonoras interactúan con el medio y con otros objetos.
1. Reflexión
Ocurre cuando una onda sonora choca con una superficie y se refleja de vuelta al medio original.
Ejemplo: El eco, que es el sonido reflejado que llega al oyente después de un breve retraso.
2. Refracción
Es el cambio de dirección de una onda sonora cuando pasa de un medio a otro con diferente densidad.
Ejemplo: Cuando el sonido viaja del aire al agua, cambia su velocidad y dirección.
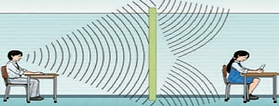
3. Difracción
Es la capacidad del sonido de rodear obstáculos y pasar a través de pequeñas aberturas.
Ejemplo: La capacidad de escuchar sonidos alrededor de una habitación o a través de una puerta entreabierta.
4. Interferencia
Ocurre cuando dos o más ondas sonoras se superponen y combinan sus efectos.
Tipos:
- Constructiva: Las ondas se suman, aumentando la amplitud del sonido.
- Destructiva: Las ondas se restan, disminuyendo la amplitud del sonido.
Ejemplo: Los patrones de ondas que se forman cuando dos altavoces emiten la misma frecuencia de sonido.
5. Resonancia
Ocurre cuando la frecuencia de un sonido coincide con la frecuencia natural de vibración de un objeto, haciendo que el objeto vibre con una mayor amplitud.
Ejemplo: Un vaso que vibra y puede romperse si se le aplica un sonido a su frecuencia de resonancia.
6. Efecto Doppler
Es el cambio en la frecuencia de una onda sonora debido al movimiento relativo entre la fuente del sonido y el observador.
Ejemplo: El cambio de tono de la sirena de una ambulancia mientras se aproxima y luego se aleja de un observador.















.jpeg)