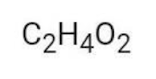11 junio, 2025
lunes, 16 de junio de 2025
Bimestral química segundo periodo (10-11)
Continuación: Nivelación - Repaso (11)
09 junio, 2025
Buenos días mis chicos, espero que hoy sea un bonito día 🥼. Hoy continuaremos con la nivelación sobre algunos temas del segundo periodo:
Conitnuación... Copiamos en el cuaderno:
📌 La característica básica de los siguientes grupos son los enlaces carbono-hidrógeno con un oxígeno de forma doble, varían según su composición:
- Cuando el carbono se unen con enlaces simples al hidrógeno y de forma doble al oxígeno, se llaman aldehídos.
- Metanal:
- Cuando los carbonos se unen a otros carbonos, de forma simple al hidrógeno y de forma doble al oxígeno, se llaman cetonas.
- Dimetil cetona:
- Cuando los carbonos se unen de forma simple al hidrógeno y de forma doble al oxígeno, además de un grupo OH, se llaman ácidos carboxílicos.
- Ácido etanoico (ácido acético):
- Cuando los carbonos se unen de forma simple al hidrógeno y de forma doble al oxígeno, además de un oxígeno de forma simple, se llaman ésteres.
- Metil etanoato:
- Cuando los carbonos se unen de forma simple al hidrógeno y de forma doble al oxígeno, además de un grupo NH₂, se llaman amidas.
- Metan amida:
- Cuando los carbonos se unen de forma simple al hidrógeno y de forma doble al oxígeno, además de un halógeno, se llaman haluros de ácido.
- Cloruro de metanoilo:
Continuación: Nivelación - Repaso (10)
09 junio, 2025
Buenos días mis chicos, espero que hoy sea un bonito día 🥼. Hoy continuaremos con la nivelación sobre algunos temas del segundo periodo:
Conitnuación... Copiamos en el cuaderno:
✅ ¿Para qué sirve la configuración electrónica?
- Nos ayuda a entender los enlaces químicos. Los e- del último nivel de energía (capa de valencia) son los que se usan para formar enlaces.
- Un ejemplo clásico son los enlaces que se forman dentro de la molécula del agua. El oxígeno tiene 6e- disponibles en su capa de valencia, y los dos hidrógenos tienen 1e- disponible cada uno en su último nivel, por lo que se forma una molécula estable.



- Una configuración e- similar implica un comportamiento similar. Los elementos que pertenecen al mismo grupo de la tabla periodica tienen el mismo número de átomos disponibles en la capa de valencia.
- Ejemplo con el Na (sodio) y el K (potasio) que pertenecen al grupo IA, ambos tienen 1e- en su capa de valencia:
Nivelación - Repaso (11)
04 junio, 2025
Buenos días mis chicos, espero que hoy sea un bonito día 🥼. Hoy realizaremos una nivelación sobre algunos temas del segundo periodo:
Copiamos en el cuaderno...
✅ Fórmulas químicas:
¿Para qué sirven las fórmulas químicas?
Es la representación gráfica de la molécula de la sustancia de estudio. Existen varias pero principalmente usaremos dos:
- Empírica: se basa en la observación y en la medida del número de átomos de cada elemento del compuesto. También es llamada mínima o condensada.
- Ejemplo con al ácido acético:
- Esquemática o estructural: tiene en cuenta la posición y la estructura de los átomos.
- Ejemplo con al ácido acético:
📌 Hidrocarburos: Es el grupo más amplio. Su característica básica son los enlaces carbono-carbono con hidrógenos, y varían según el tipo de enlace:
- Enlace sencillo: Cuando los carbonos se unen con enlaces simples a otros carbonos, se llaman alcanos.
- Etano:
- Enlace doble: Cuando los carbonos se unen con enlaces dobles a otros carbonos, se llaman alquenos.
- Eteno:
- Enlace triple: Cuando los carbonos se unen con enlaces triples a otros carbonos, se llaman alquinos.
- Etino:
- Anillos: Cuando los carbonos se unen de forma continua (como un anillo) a otros carbonos, se llaman compuestos aromáticos.
- Benceno:
Cloro etano:
Metanol:
📌 Nitrilos: Su característica básica son los enlaces carbono-hidrógeno con oxígeno de forma triple.
Nivelación - Repaso (10)
04 junio, 2025
Buenos días mis chicos, espero que hoy sea un bonito día 🥼. Hoy realizaremos una nivelación sobre algunos temas del segundo periodo:
Copiamos en el cuaderno...
✅ Distribución de los electrones en el átomo:
¿A qué nos referimos con la distribución de los electrones en el átomo?
- Niveles de energía: van del 1 al 7, siendo así 1, 2, 3, 4, 5, 6 y 7, también pueden ser representados con las letras del alfabeto respectivamente K, L, M, N, O P y Q.
- Subniveles de energía: son cuatro y se nombran como s, p d y f.
- Exponentes: es el número máximo de electrones que puede albergar un subnivel.
✅ ¿Para qué sirve la configuración electrónica?
- Nos ayuda a entender el comportamiento de los elementos, teniendo en cuenta su último orbital:
- Cuando tiene pocos e- (1-2-3) → Pierden
- Por ejemplo, el sodio (Na) tiene 1e- en su último nivel.
- Cuando tiene su último orbital casi lleno de e- (5-6-7) → Ganan
- Por ejemplo, el cloro (Cl) tiene 7e- en su último nivel.
- Cuando tiene un número intermedio de e- (4) → Comparten
- Por ejemplo, el carbono (C) tiene 4e- en su último nivel.
martes, 10 de junio de 2025
EVALUACIÓN PARCIAL FISICA
MUCHACHOS BUENOS DÍAS!
Les recuerdo que hoy tendremos nuestro examen bimestral, así que por favor preparen sus útiles, guarden sus apuntes y concéntrense.
El examen evaluará los temas que hemos trabajado durante estas últimas semanas en el curso de física, así que es muy importante que lean con atención, administren bien su tiempo y respondan con calma y seguridad.
Recuerden:
✅ Lean bien cada pregunta.
✅ Revisen antes de entregar.
✅ Y confíen en lo que han aprendido.